MARCO
TEÓRICO
TERMODINÁMICA
Es la parte de la física que
estudia las transferencias de calor, la conversión de la energía y la capacidad
de los sistemas para producir trabajo. Las leyes de la termodinámica explican
los comportamientos globales de los sistemas macroscópicos en situaciones de
equilibrio. Tiene las siguientes características:
· Se aplica al estudio de sistemas que
contienen muchas partículas y no al estudio de moléculas, átomos o partículas
subatómicas.
· Estudia el sistema en situaciones de equilibrio,
que son aquellas a las que sistema tiende a evolucionar y caracterizadas porque
en ellas todas las propiedades del sistema quedan determinadas por factores
intrínsecos y no por influencias externas previamente aplicadas.
· Sus postulados son indemostrables, están
basados en las experiencias y no en razonamientos teóricos.
Componentes
de un sistema termodinámico:

Definición de los componentes termodinámicos:
Los sistemas termodinámicos: se
clasifican según el grado de aislamiento que presentan con su entorno.
Aplicando este criterio pueden darse tres clases de sistemas:
Sistema
aislado: Es aquel que no intercambia ni materia ni energía con su
entorno, es decir se encuentra en equilibrio termodinámico. Un ejemplo de esta
clase podría ser un gas encerrado en un recipiente de paredes rígidas lo
suficientemente gruesas (paredes adiabáticas) como para considerar que los
intercambios de energía calorífica sean despreciables y que tampoco puede
intercambiar energía en forma de trabajo.
Sistema
cerrado: Es el que puede intercambiar energía pero no materia con
el exterior. Multitud de sistemas se pueden englobar en esta clase. Una lata de
sardinas también podría estar incluida en esta clasificación.
Sistema abierto: En esta clase se
incluyen la mayoría de sistemas que pueden observarse en la vida cotidiana. Por
ejemplo, un vehículo motorizado es un sistema abierto, ya que intercambia
materia con el exterior cuando es cargado, o su conductor se introduce en su
interior para conducirlo, o es provisto de combustible al repostarse, o se
consideran los gases que emite por su tubo de escape pero, además, intercambia
energía con el entorno. Solo hay que comprobar el calor que desprende el motor
y sus inmediaciones o el trabajo que puede efectuar acarreando carga.

La frontera:
(pared) de un sistema es el límite que señala la superficie de contacto que
comparten el sistema y el ambiente. Se supone idealmente que la frontera tiene
un grosor cero por lo que no contiene ni masa ni ocupa ningún volumen en el
espacio. La frontera o límite de un sistema puede estar fijo o se puede mover.
Entorno: la
región del universo exterior del sistema con la que puede intercambiar energía,
calor o trabajo es llamada ambiente, alrededores o entorno.
La termodinámica se rige por lo establecido
en sus cuatro principios o leyes fundamentales, formuladas por diversos
científicos a lo largo de la historia de esta disciplina. Dichos principios o leyes son:
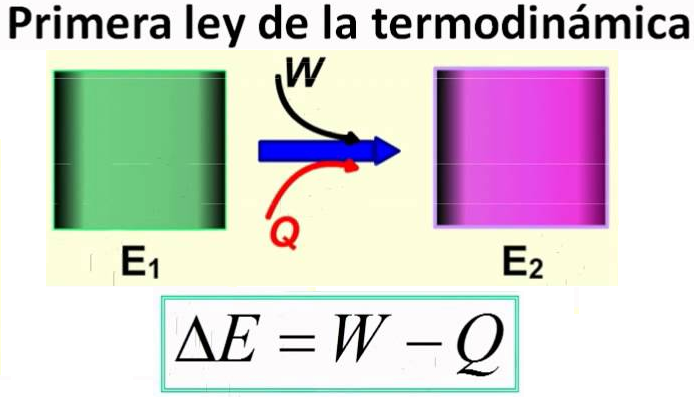
Primer principio, o
Ley de la Conservación de la energía. Establece que la cantidad total
de energía en cualquier sistema físico aislado de su entorno, será siempre la
misma aunque pueda transformarse de una forma de energía a muchas otras
diferentes. En menos palabras: “La energía no puede crearse ni destruirse, sólo
transformarse”.
Segundo principio, o
Ley de la Entropía. Esta ley dicta que “la cantidad de entropía en el universo tiende a
incrementarse en el tiempo”, lo cual significa que el grado de desorden de los
sistemas (la entropía) aumenta una vez que alcancen un punto de equilibrio.
Así, dado el tiempo suficiente, todos los sistemas tenderán al desequilibrio.
Con esta ley se explica la irreversibilidad de los fenómenos físicos: una vez
quemado un papel, no puede hacer que regrese a su forma inicial.

Tercer principio, o
Ley del cero absoluto. Dicta que la entropía de un sistema que sea
llevado al cero absoluto será siempre una constante definida, lo cual dicho en
otras palabras significa que al llegar al cero absoluto (-273,15 °C o 0 K), los
procesos de los sistemas físicos se detienen, y la entropía poseerá un valor
mínimo constante.

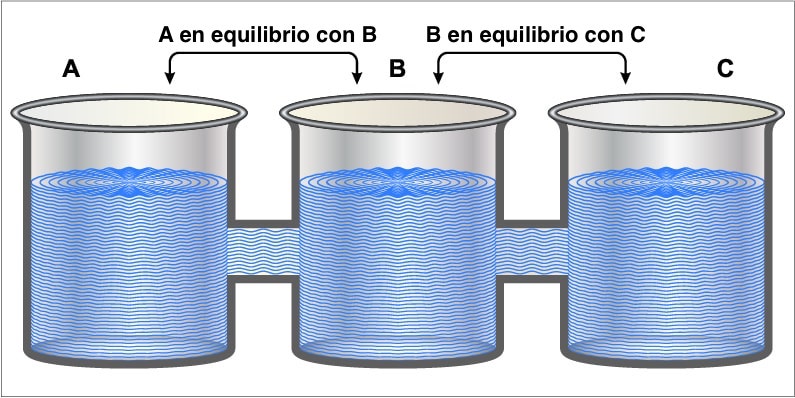
Principio cero o Ley
del equilibrio térmico. Se llama “ley cero” porque, si bien fue la
última en postularse, los preceptos básicos y fundamentales que establece
tienen prioridad sobre las otras tres leyes. Dicta que “Si dos sistemas están
en equilibrio térmico de forma independiente con un tercer sistema, deben estar
también en equilibrio térmico entre sí”.
CALOR
TIPOS DE CALOR
En termodinámica,
calor significa “transferencia de energía”. Esta transferencia se produce a
través del rozamiento entre uno y otro cuerpo y siempre se traspasa del más
caliente al más frío para lograr el equilibrio.
Latente. Es la energía necesaria
para modificar la fase de determinado volumen de
una sustancia, pasando de sustancias sólidas a líquidas o bien, de líquidas a
gaseosas.
Sensible. Es el calor que genera una
modificación en la temperatura de la sustancia que lo percibe. Si bien
incrementa la temperatura del cuerpo, este calor no interfiere ni en su estado
ni en su estructura molecular.
Seco. Consiste en un método térmico de esterilización que genera en
los microorganismos que conforman al
cuerpo un efecto similar al horneado.
De
fusión. Consiste
en esa energía que consigue cambiar un gramo de una sustancia sólida a estado
líquido sin modificar su temperatura. Este calor tiene la capacidad de romper
los enlaces sólidos de la materia.
Específico. Se trata de la cantidad de
calor necesaria para incrementar en un grado la temperatura de la unidad
de masa de un compuesto en un grado. En este caso, la energía
proviene de la modificación de otras energías y es el resultado del movimiento vibratorio de átomos y moléculas que conforman las
sustancias.
Específico molar. Se vincula con la
constitución molecular interna de la sustancia.
El calor se puede transmitir de tres formas diferentes:
El calor se puede transmitir de tres formas diferentes:
- Irradiación
térmica. El
calor se propaga a través de ondas magnéticas y, por lo tanto,
los dos cuerpos no necesariamente deben estar en contacto.
- Conducción
térmica. El
calor se transmite por la agitación de las moléculas, lo que provoca
que la temperatura incremente, que los líquidos se evaporen, que
los sólidos se fundan y que los cuerpos se dilaten.
- Convección térmica. El calor se transfiere entre gases y líquidos.

TEMPERATURA:
La temperatura se refiere a
una magnitud utilizada para medir la energía cinética de un sistema
termodinámico, que se genera con los movimientos de las partículas que son
parte del sistema. A mayor movimiento, aumenta la temperatura, mientras que a
menor movimiento, la temperatura tiende a disminuir.
Las unidades de medida de
temperatura son los grados Celsius (ºC), los grados Fahrenheit (ºF) y los
grados Kelvin (K). El cero absoluto (0 K) corresponde a -273,15 Celsius.
El grado Rankine tiene su punto de cero absoluto a −459,67 °F, y los intervalos de grado son idénticos al intervalo de grado Fahrenheit. Usado comúnmente en EE.UU. como medida de temperatura termodinámica.
El grado Rankine tiene su punto de cero absoluto a −459,67 °F, y los intervalos de grado son idénticos al intervalo de grado Fahrenheit. Usado comúnmente en EE.UU. como medida de temperatura termodinámica.

Temperatura
de fusión y ebullición
Cuando nos referimos al
punto de fusión estamos hablando de la temperatura en la cual la materia se
encuentra en estado sólido y luego se transforma a un estado líquido.
Del mismo modo, una vez que
la materia en estado líquido continúa aumentando su temperatura, puede alcanzar
su punto de ebullición, es decir que pasa de estado líquido a estado gaseoso.
El punto de fusión del agua
es de 0 °C, y su punto de ebullición es de 100 °C, por lo cual mientras se
encuentra a menos de 0° C se encuentra en estado sólido, en forma de hielo, y
cuando esta entre 1 °C y 99 °C se encuentra estado líquido.
CONVERSIONES
DE TEMPERATURA
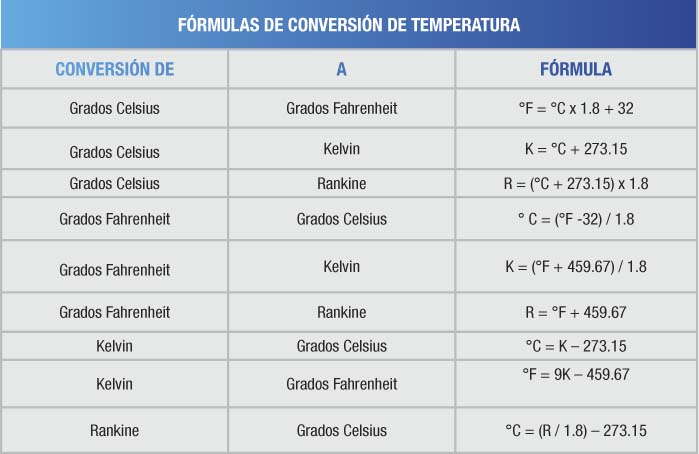
De Kelvin a Celsius y viceversa
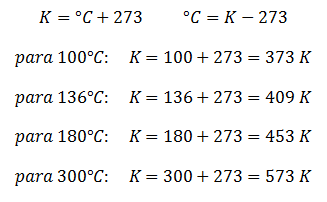
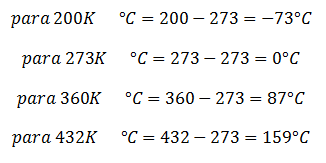
De Rankine a Fahrenheit y viceversa
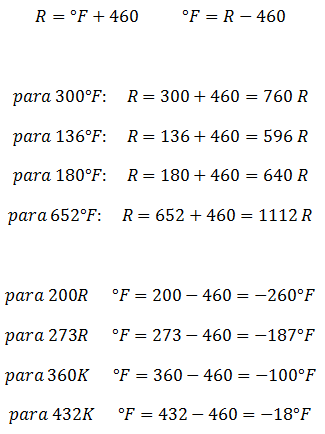
De Fahrenheit a Celsius

De Celsius a Fahrenheit:
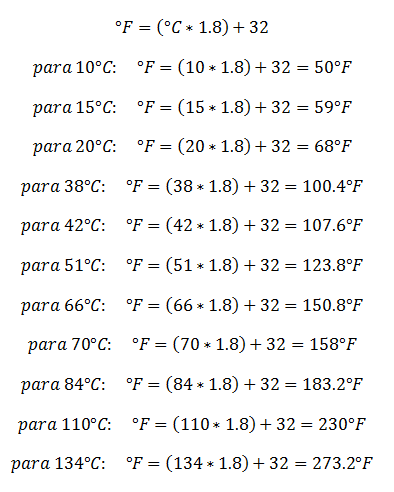
GRUPO 11
ELABORADO POR: CÉSAR PAULINO FLORES MORALES
Comentarios
Publicar un comentario